Противомикробные лекарственные средства. Антибактериальные средства: классификация
В свое время обычные правила гигиены совершили настоящий переворот в подходе к профилактике инфекций. Даже регулярное мытье рук позволило существенно сократить распространение множества болезней, в том числе кишечных расстройств и гнойных поражений. Средства для личной гигиены постоянно совершенствуются, и сегодня рынок переполнен товарами с антибактериальным эффектом. Мы расскажем, насколько они эффективны, когда их следует применять, а в каких случаях лучше отказаться.
Антибактериальные гигиенические средства - продукты, содержащие в своем составе вещества, являющиеся антибактериальными агентами. Наиболее часто в этой роли выступает триклозан - антибактериальный и противогрибковый компонент широкого спектра действия. К нему чувствительны большинство грибков, поражающих кожные покровы, а также бактерии родов стафилококк и стрептококк.
В некоторых средствах в составе присутствует аналог триклозана - триклокарбан. Также в качестве антибактериального агента может выступать антисептик хлоргексидин, противомикробный препарат метронидазол и другие. Однако по эффективности они существенно уступают триклозану, поэтому применяются реже.
Антибактериальными гигиеническими средствами могут быть:
- Мыло (жидкое и твердое).
- Шампуни.
- Гели для тела.
- Гели для интимной гигиены.
- Дезодоранты.
- Зубные пасты.
- Ополаскиватели для полости рта.
- Влажные салфетки.
- Спреи для рук.
Также триклозан входит в состав многих средств бытовой химии, и в таком случае они будут отмечены, как антибактериальные. Таковыми могут быть гели для мытья поверхностей, средства для чистки унитазов и даже стиральные порошки.
Бактерии - главная причина множества тяжелых заболеваний. Некоторые виды этих микроорганизмов в процессе жизнедеятельности выделяют экзотоксины, которые сегодня считаются наиболее опасными ядами и способны провоцировать тяжелейшие генерализованные инфекции. Именно бактерии являются причиной сепсисов, гнойных воспалений, тяжелых поражений легких, кишечных заболеваний и многих других болезней.
Наиболее часто организм поражают золотистый стафилококк, стрептококк, кишечная палочка (наибольшую опасность представляет для внутренних органов). Однако все эти микроорганизмы могут обнаруживаться на коже и слизистых здорового человека и при этом не провоцировать развитие болезни. Поэтому их принято относить к условно-патогенной микрофлоре. Это значит, что при нормальном иммунитете и состоянии кожных покровов микробы не ведут себя как патогенные, а способны уживаться с другими микроорганизмами и не отражаться на здоровье. Для примера, опасный золотистый стафилококк обнаруживается у каждого четвертого жителя планеты. А стрептококк способен даже подавлять размножение патогенных бактерий типа сальмонелл.
По большому счету микрофлора, обитающая на коже и слизистых, всегда является условно-патогенной - в числе микроорганизмов присутствуют колонии разных бактерий. Вызывать инфекции они могут в том случае, если баланс нарушится - это даст возможность микробам неконтролируемо размножаться.
Триклозан (и его аналоги) - антибактериальное средство широкого действия, а это значит, что действует оно не избирательно. При нанесении его на кожу страдают все представители микрофлоры, тем самым серьезно нарушается установленный баланс. Это, в свою очередь, создает благоприятные условия для развития инфекций. Поэтому средства гигиены с антибактериальным эффектом при частом использовании могут нанести серьезный вред здоровью.
Патогенные микроорганизмы способны вырабатывать новые защитные механизмы, в том числе и против используемых лекарств. Это и называется резистентностью - устойчивостью к действующему веществу. Особенно ярко эту способность проявляет золотистый стафилококк - один из наиболее опасных микробов. Изначально он легко уничтожался пенициллином, сегодня же существует немало штаммов бактерии, которые в процессе эволюции научились вырабатывать специальный фермент, пенициллиназу, которая просто расщепляет антибиотик.
С каждым годом обнаруживается все большее число бактерий, резистентных к существующим лекарствам. Медики связывают эту тенденцию с неконтролируемым применением антибактериальных средств разных видов. Постоянно воздействуя на колонии бактерий, человек тем самым ускоряет их естественный отбор - выживают и в дальнейшем размножаются уже устойчивые штаммы.
Кроме общего вреда, приносимого триклозаном как одним из антибиотиков широкого спектра действия, на сегодняшний день доказан и вред самого действующего вещества. Последние новости медицины: триклозан необходимо исключить из состава жидких и твердых мыл. К такому решению пришло FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США). В штате Миннесота триклозан выведен из списка всех видов потребительских товаров. Закон вступит в силу с 1 января 2017 года.
Такие меры приняты по результатам нескольких исследований действующего вещества, в ходе которых были сделаны следующие выводы:
- Триклозан способен вызвать рак печени. Связано это с тем, что он подавляет работу андростанового рецептора, который участвует в выведении токсинов из организма. В результате ткани перерождаются в фиброзные, что и провоцирует онкологию.
- Триклозан может быть причиной бесплодия, негативно влиять на течение беременности и развитие плода. Триклозан способен накапливаться, он был обнаружен даже в пуповинной крови.
- Эффективность антибактериальных средств для рук и тела при длительном применении не доказана. Бактерии уничтожаются частично, а под воздействием окружающей среды их количество быстро восстанавливается.
И все же использование антибактериальных гигиенических средств в некоторых случаях вполне оправдано.
- Антибактериальный эффект полезен при использовании различных очищающих спреев для рук и влажных салфеток, если они используются в поездках, походах и прочем. Речь идет о временном использовании в среде с высоким риском заражения бактериальными инфекциями и ограниченными возможностями соблюдения личной гигиены.
- Эффективность триклозана доказана в зубных пастах. Вещество действительно снижает риск развития гингивитов и других воспалений полости рта, а также уменьшает образование зубного камня.
Полностью отказываться от антибактериальных средств гигиены не стоит. Однако применять их ежедневно и без существенных показаний все же не рекомендуется. Как и любое активное вещество, антибактериальные агенты должны использоваться лишь при очевидной необходимости.
Вернуться к номеру
Характеристика основных групп антибактериальных препаратов, применяемых в медицине критических состояний
Антибиотики классифицируют по результату воздействия на микрофлору, химическому строению и механизму действия.
Основой классификации антибактериальных препаратов (АБП) является их химическое строение. Классификация антибиотиков в соответствии с их химическим строением приведена в табл. 1.
Формально под термином «антибиотики» понимают только те вещества, которые вырабатываются микробами. Следовательно, такие антибактериальные или противомикробные средства, как сульфаниламиды, хинолоны и триметоприм, строго говоря, не антибиотики.
Если исходить из общетеоретических понятий бактерицидности и бактериостатичности, то эти понятия относительные, так как обе группы препаратов нарушают синтез белка в различных структурах клетки. Разница лишь в том, что бактерицидная активность зависит от величины концентрации препарата в биологических жидкостях, а бактериостатическая — не зависит или мало зависит от нее. По результату воздействия на микроорганизмы выделяют бактерицидные антибиотики, уничтожающие микробную клетку, и бактериостатические — подавляющие ее рост и размножение. Бактерицидные препараты используются при тяжелых острых инфекционных процессах Острый инфекционный процесс обусловливается интенсивным делением клеток. Действие на делящиеся клетки с нарушение синтеза белка — процесс не длительный, поэтому препараты бактерицидного действия — недлительного применения, их используют до получения клинического эффекта.
Бактериостатические препараты — препараты длительного использования для лечения хронического течения или инфекций в стадии утихания острых процессов. Однако к макролидам, рифампицину, линкомицину, фузидину быстро развивается устойчивость, поэтому их рекомендуют применять короткими курсами до 5 дней. По механизму действия антибиотики, как правило, делят на 3 группы:
I группа — антибиотики, нарушающие синтез микробной стенки во время митоза: пенициллины, цефалоспорины (ЦС), карбапенемы, монобактамы (азтреонам), ристомицин, фосфомицин, гликопептидные препараты (ванкомицин, тейкопланин). По фармакологическому эффекту препараты этой группы являются бактерицидными антибиотиками.
II группа — антибиотики, нарушающие функцию цитоплазматической мембраны: полимиксины, полиеновые препараты (нистатин, леворин, амфотерицин В и др).
По фармакологическому эффекту они также являются бактерицидными.
III группа — антибиотики, нарушающие синтез белков и нуклеиновых кислот: левомицетин, тетрациклины, линкозамиды (линкомицин, клиндамицин), макролиды (эритромицин, рокситромицин, азитромицин и др.), рифамицины, фузидин, гризеофульвин, аминогликозиды (АГ) (канамицин, гентамицин, нетилмицин и др.).
По фармакологическому эффекту они являются бактериостатическими. Исключение составляет амикацин, который действует бактерицидно независимо от концентрации.
В последнее время принято разделение антибиотиков по механизму действия на 5 основных групп (табл. 2).

Характеристика основных групп АБП
С целью систематизации использования АБП существует Перечень жизненно важных лекарственных средств ВОЗ (WHO Моde1 List of essential Drugs). Представленный ВОЗ перечень является примерной моделью разработки такого списка в каждой стране с учетом особенностей местного здравоохранения. Как показывает практика, количество антимикробных препаратов примерно совпадает в разных странах. В своем обзоре мы хотим представить основные АБП, которые используются в медицине критических состояний.
Пенициллины
Пенициллиназостабильные пенициллины. Спектр антимикробной активности оксациллина близок к природным пенициллинам (грамположительные бактерии), однако уровень активности против стрептококков и пневмококков в несколько раз ниже; не действует на энтерококки, гонококки и анаэробные бактерии. Основным отличием оксациллина от природных и других полусинтетических пенициллинов является устойчивость к стафилококковым бета-лактамазам — ферментам, разрушающим бета-лактамное кольцо пенициллинов.
Оксациллин является высокоактивным средством в отношении золотистого и коагулазонегативных стафилококков, однако не действует на стафилококки с другим механизмом устойчивости — так называемые метициллин- или оксациллин-резистентные стафилококки. Основные показания для оксациллина — инфекции, вызванные стафилококками, чувствительными к оксациллину, а также при предполагаемой стафилококковой этиологии (острый артрит, острый остеомиелит, неосложненные инфекции кожи и мягких тканей, эндокардит трикуспидального клапана). Адекватный режим дозирования оксациллина при госпитальных стафилококковых инфекциях — 2 г внутривенно с интервалом 4-6 ч. При пероральном приеме оксациллин плохо всасывается в пищеварительном тракте, поэтому предпочтительнее использовать клоксациллин или диклоксациллин.
Аминопенициллины обладают более широким спектром активности по сравнению с природными пенициллинами за счет некоторых грамотрицательных бактерий — Е.соli, Shigella spp., Salmonella spp., Proteus mirabilis, Haemophilus influenzae (преимущественно внебольничные штаммы); препараты проявляют также активность в отношении анаэробных микроорганизмов, но уровень резистентности к ним высокий. В то же время аминопенициллины гидролизуются β-лактамазами стафилококков и грамотрицательных бактерий, поэтому не имеют в настоящее время существенного значения при лечении внутрибольничных инфекций.
Ампициллин применяется парентерально (при пероральном приеме низкая биодоступность) при внебольничной пневмонии, инфекционном эндокардите, менингите. Амоксициллин применяется при нетяжелых внебольничных респираторных инфекциях, а также может назначаться для замены ампициллина при ступенчатой терапии.
Ингибиторзащищенные аминопенициллины не разрушаются большинством бета-лактамаз грамотрицательных бактерий, в результате чего их спектр антимикробной активности по сравнению с незащищенными препаратами более широкий в отношении некоторых грамотрицательных бактерий (Klebsiella spp., Proteus vulgaris, Moraxella catarrhalis, Citrobacter diversus ) и анаэробов (Bacteroides fragilis ). Основное показание для применения ингибиторзащищенных пенициллинов в стационаре — интраоперационная профилактика послеоперационных гнойно-септических осложнений. С этой целью препарат вводится в однократной дозе за 30-60 мин до операции (амоксициллин/клавуланат 1,2 г, ампициллин/сульбактам (амписульбин-КМП) 3 г, уназин) . Ингибиторзащищенные пенициллины высокоэффективны при абсцедирующей пневмонии и нетяжелых инфекциях малого таза. Амоксициллин/клавуланат также является базовым средством для лечения госпитализированных больных с внебольничной пневмонией средне-тяжелого течения или обострением хронического бронхита. При госпитальных инфекциях (пневмония, перитонит, кожи и мягких тканей) значение этих препаратов невелико из-за существенного уровня резистентности основных возбудителей.
Карбоксипенициллины и уреидопенициллины. Эти препараты обычно объединяют одним названием — антипсевдомонадные пенициллины. Они обладают более широким спектром активности по сравнению с аминопенициллинами (чувствительны большинство бактерий семейства Enterobacteriaceae, Рseudomonas aeruginosa ), однако эти препараты разрушаются β-лактамазами грамотрицательных бактерий и стафилококков, поэтому применение их в настоящее время ограничено. Основное показание — псевдомонадные инфекции, однако следует учитывать возросший уровень устойчивости Р.аeruginosa к карбокси- и уреидопенициллинам. При назначении этих препаратов при псевдомонадной инфекции (при установленной чувствительности!) следует их комбинировать с аминогликозидами, использовать адекватные дозировки: карбенициллин внутривенно 4-5 г с интервалом 4 ч, пиперациллин внутривенно 2-4 г с интервалом 6-8 ч. При использовании антипсевдомонадных пенициллинов (особенно карбоксипенициллинов!) необходимо контролировать электролиты в крови и показатели свертываемости крови.
Защищенные антипсевдомонадные пенициллины. Имеют более широкие показания при внутрибольничных инфекциях, однако следует также учитывать увеличившуюся в последние годы устойчивость грамотрицательных бактерий к этим препаратам. Тикарциллин/клавуланат и пиперациллин/тазобактам применяются в основном при смешанных аэробно-анаэробных инфекциях — интраабдоминальные и гинекологические инфекции, легочные нагноения. Целесообразно сочетание этих препаратов с аминогликозидами, особенно при тяжелых инфекциях. Режим дозирования тикарциллин/клавуланата составляет 3,2 г внутривенно с интервалом 6-8 ч, пиперациллин/тазобактама — 2,5-4,5 г с интервалом 8 ч.
Цефалоспорины
Потребление цефалоспоринов «так резко возросло, что можно сравнить его с первоначальной реакцией на появление пенициллина». Считаются самыми назначаемыми в ОИТ АБП в мире (рис. 1).
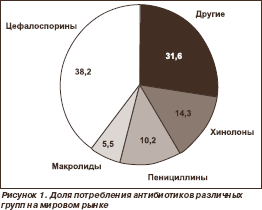
В эту группу входят препараты с различным спектром антимикробной активности, поэтому в зависимости от спектра их разделяют на поколения. Общим для всех цефалоспоринов (кроме цефоперазон/сульбактама) является слабая активность в отношении анаэробных микроорганизмов (поэтому при смешанных инфекциях их следует комбинировать с метронидазолом или линкозамидами). Все ЦС не активны в отношении энтерококков, метициллинрезистентных стафилококков, листерий и атипичных микроорганизмов (легионелла, хламидии, микоплазма).
Цефалоспорины I поколения. Обладают преимущественной активностью в отношении грамположительных бактерий (стафилококки, стрептококки, пневмококки) и некоторых грамотрицательных — Е.соli , Shigella spp., Salmonella sрр., Р.mirabilis .
Однако в связи с широким распространением приобретенной устойчивости госпитальных штаммов грамотрицательных бактерий клиническое значение цефалоспоринов I поколения при этих инфекциях невелико. Основная область клинического применения цефазолина в стационаре — установленная стафилококковая инфекция различной локализации.
Цефалоспорины II поколения, представителем которых является цефуроксим (зинацеф, кимацеф), обладающие более широким спектром активности против грамотрицательных бактерий, находят более широкое применение при внутрибольничных инфекциях, однако в большинстве случаев их целесообразно сочетать с аминогликозидами. Цефуроксим эффективен при неосложненной внебольничной пневмонии. Показан для профилактики инфекционных осложнений после операций.
Цефалоспорины III поколения характеризуются высокой активностью в отношении грамотрицательных энтеробактерий, причем цефотаксим и цефтриаксон превосходят цефтазидим и цефоперазон. Принципиальное различие между этими препаратами заключается в действии на синегнойную палочку: цефотаксим и цефтриаксон не обладают значимой активностью против Р.аeruginosa (их целесообразно выделить в подгруппу IIIа), цефтазидим и цефоперазон активны в отношении Р.аeruginosa (цефтазидим несколько превосходит цефоперазон) — подгруппа IIIб. Соответственно различается и место этих цефалоспоринов при внутрибольничных инфекциях. Цефтазидим (цефтум) и цефоперазон (гепацеф, цефобид) являются базовыми препаратами при лечении установленных псевдомонадных инфекций или заболеваний с высоким риском наличия Р.аeruginosa . Цефоперазон, в высоких концентрациях проникающий в желчь, также показан для лечения инфекций желчевыводящих путей. Цефотаксим и цефтриаксон (офрамакс) являются в настоящее время базовыми препаратами при лечении различных госпитальных инфекций. Уровень активности у этих цефалоспоринов одинаков, различия между ними связаны со скоростью элиминации: период полувыведения цефтриаксона составляет около 8 ч, поэтому препарат назначается в дозе 2 г с интервалом 24 ч, цефотаксим выводится быстрее, поэтому обычно дозируется 2 г с интервалом 6-8 ч.
Цефалоспорины IV поколения. Представлены в настоящее время одним препаратом — цефепимом (максипим), обладающим наиболее широким и сбалансированным спектром антимикробной активности среди цефалоспориновых антибиотиков. Клинически важно, что цефепим может сохранять активность в отношении некоторых штаммов Enterobacteriaceae (прежде всего Enterobacter spp., Serratia spp., Morganella morganii , Providencia rettgeri, C.freundii , являющихся гиперпродуцентами хромосомных бета-лактамаз класса С), резистентных к цефалоспоринам III поколения. Цефепим также проявляет активность в отношении некоторых штаммов Klebsiella spp., продуцирующих бета-лактамазы расширенного спектра, однако ряд штаммов устойчив. Основная область применения цефепима в клинике — тяжелые внутрибольничные инфекции, особенно в случае резистентных к цефалоспоринам III поколения энтеробактерий. Цефепим может применяться в клинике в схемах ротации, т. е. для временной замены в схемах эмпирической терапии цефалоспоринов III поколения в случае высокой к ним резистентности. Показано, что периодическая ротация цефалоспоринов III поколения на цефепим в отделениях реанимации и интенсивной терапии (ОПТ) позволяет ограничить рост устойчивых штаммов микроорганизмов и даже восстановить чувствительность микробов к цефалоспоринам III поколения.
Ингибиторзащищенные цефалоспорины. Комбинация антипсевдомонадного цефалоспорина III поколения цефоперазона и ингибитора бета-лактамаз сульбактама — цефоперазон/сульбактам (сульперазон) — обладает более широким спектром действия, чем ЦС III поколения, за счет сохранения активности против энтеробактерий и анаэробов, продуцирующих β-лактамазы, в том числе расширенного спектра (ЕSВL), и разрушающих другие ЦС. Препарат применяется при лечении тяжелых госпитальных инфекций различной локализации, причем при смешанных аэробно-анаэробных инфекциях может применяться в режиме монотерапии.
Карбапенемы
На украинском фармацевтическом рынке представлены в основном двумя антибиотиками — имипенемом/циластатином (тиенам) и меропенемом (меронем). Характеризуются наиболее широким спектром антимикробной активности среди всех бета-лактамных антибиотиков — грамположительные и грамотрицательные аэробные бактерии, анаэробы. Из возбудителей внутрибольничных инфекций природную устойчивость к карбапенемам проявляют только три микроорганизма: Enterococcus faecium , Stenotrophomonas maltophilia , а также метициллинрезистентные штаммы Staphylococcus sрр. Клинически важно, что вторичная устойчивость госпитальных штаммов микроорганизмов к карбапенемам развивается крайне редко (исключение — Р.аеruginosa ). Резистентность Р.аеruginosa к карбапенемам выше и в ОИТ может достигать 15-20 %. Карбапенемы сохраняют активность в отношении штаммов Enterobacteriaceae , резистентных н цефалоспоринам III и IV поколений, аминогликозидам и фторхинолонам (ФХ). Имипенем характеризуется несколько более высокой активностью in v itro в отношении грамположительных микроорганизмов, меропенем проявляет более высокую активность в отношении грамотрицательных бактерий (клинически эти различия вероятно не значимы); активность препаратов против анаэробов одинакова и превосходит таковую у метронидазола и линкозамидов. Карбапенемы применяются для лечения тяжелых внутрибольничных инфекций, вызванных полирезистентной и смешанной микрофлорой, прежде всего при неэффективности препаратов первого ряда — цефалоспоринов или фторхинолонов. В контролируемых клинических исследованиях показано, что карбапенемы равноэффективны или превосходят стандартные комбинированные режимы антибактериальной терапии на основе цефалоспоринов (или полусинтетических пенициллинов) и аминогликозидов.
Основные показания для карбапенемов: интраабдоминальные инфекции, послеоперационные раневые инфекции, внутрибольничная пневмония, в том числе связанная с ИВЛ, легочные нагноения (абсцесс, эмпиема), инфекции органов малого таза, осложненные инфекции мочевыводящих путей с сепсисом, остеомиелит, менингит (только меропенем ). Следует подчеркнуть, что при жизнеугрожающих инфекциях карбапенемы необходимо рассматривать не как резервные средства, а как антибиотики первого ряда, так как прогноз у тяжелых больных может быть улучшен только в случае возможно более раннего назначения адекватной антибактериальной терапии. К таким ситуациях прежде всего следует отнести инфекционные осложнения у больных в ОРИТ, находящихся на ИВЛ (особенно при АРАСНЕ II > 20), инфекции, вызванные Р.аеruginosa и Acinetobacter sрр., грамотрицательными бактериями (прежде всего, Klebsiella sрр., P.vulgaris ), продуцирующими бета-лактамазы расширенного спектра, инфекции у больных с иммунодефицитом (фебрильная нейтропения), гнойный послеоперационный менингит, вызванный грамотрицательными бактериями или Р.аеruginosa .
В последнее время в клинической практике появился новый карбапенем — эртапенем, МSD (инванз), который характеризуется улучшенными фармакокинетическими свойствами и назначается 1,0 грамма 1 раз в сутки; способ введения: внутримышечно и внутривенно.
Аминогликозиды
Выделяют препараты трех поколений. АГ I поколения (стрептомицин, канамицин) в настоящее время применяются исключительно во фтизиатрии. АГ II (гентамицин, тобрамицин) и III поколения (нетилмицин, амикацин (амикин, амицил) ) широко применяются в клинической практике. АГ обладают широким спектром природной антимикробной активности, однако препараты слабо действуют на стрептококки и пневмококки и не активны в отношении анаэробных бактерий. Наиболее высокие значения МПК in vitro против грамотрицательных бактерий отмечаются у амикацина, однако это компенсируется более высокими дозами амикацина по сравнению c другими аминогликозидами и соответственно более высокими сывороточными концентрациями. Уровень приобретенной резистентности грамотрицательных бактерий существенно варьирует и различается между различными аминогликозидами. Устойчивость к аминогликозидам нарастает в следующем порядке: амикацин < нетилмицин < гентамицин = тобрамицин, т.е. штаммы грамотрицательных бактерий, резистентные к амикацину, будут также резистентны к другим аминогликозидам, штаммы, резистентные к нетилмицину, могут сохранять чувствительность к амикацину, но всегда будут устойчивы к гентамицину и тобрамицину. В отношении стафилококков эталонным аминогликозидом является гентамицин: при устойчивости стафилококков к гентамицину другие АГ также будут не активны.
К недостаткам аминогликозидов, ограничивающим их применение, следует отнести токсичность (нейротоксичность, ототоксичность, нефротоксичность), плохое проникновение в ткани бронхолегочной системы, снижение активности при гнойных процессах. С целью уменьшения нефротоксических эффектов целесообразно однократное введение суточной дозы аминогликозидов (данный подход не применяется при инфекционном эндокардите, нейтропении, у новорожденных). Учитывая указанные недостатки, АГ при внутрибольничных инфекциях следует применять только в комбинации с другими антибиотиками. В стационаре оптимально использовать два аминогликозида — гентамицин и амикацин. Первый рациональнее применять в отделениях общего профиля; амикацин, из-за невысокого уровня резистентности к нему — в ОРИТ, а также при псевдомонадных инфекциях. Нетилмицин не имеет существенных преимуществ по сравнению с амикацином, но стоимость его выше.
АГ применяются также в базовых схемах этиотропной терапии некоторых инфекций: Enterococcus faecalis : гентамицин + ампициллин (бензилпенициллин); Enterococcus faecium : гентамицин + ванкомицин (тейкопланин); Streptococcus viridans (эндокардит): гентамицин + бензилпенициллин (цефтриаксон); Pseudomonas aeruginosa : амикацин (гентамицин) + цефтазидим (цефоперазон, цефепим).
Фторхинолоны
Обладают широким спектром антимикробной активности. Наиболее высокую активность проявляют в отношении грамотрицательных бактерий, включая P.aeruginosa . Активность в отношении стафилококков менее выражена, в отношении стрептококков и пневмококков — слабая. В последние годы появились ФХ с повышенной активностью против грамположительных бактерий (моксифлоксацин, авелокс). ФХ характеризуются невысокой природной активностью в отношении анаэробов, поэтому при смешанных инфекциях целесообразна их комбинация с линкозамидами (линкомицин или далацин С) или метронидазолом.
В последние годы отмечается рост устойчивости госпитальных штаммов грамотрицательных бактерий к фторхинолонам, прежде всего у P.aeruginosa . Уровень устойчивости грамотрицательных бактерий к ранним фторхинолонам условно можно расположить в следующей последовательности: ципрофлоксацин (цифран) < офлоксацин (заноцин) = пефлоксацин < ломефлоксацин.
ФХ в настоящее время рассматриваются как препараты второго ряда (после цефалоспоринов) при лечении различных госпитальных инфекций. В некоторых ситуациях ФХ могут использоваться в качестве средств первого ряда, например, при высоком уровне устойчивости в стационаре грамотрицательных бактерий к цефалоспоринам.
Гликопептиды
К гликопептидам относятся природные антибиотики — ванкомицин и тейкопланин. Ванкомицин применяется в клинической практике с 1958 г., тейкопланин — с середины 80-х. В последние годы возрос интерес к гликопептидам в связи с увеличением частоты госпитальных инфекций, вызванных грамположительными микроорганизмами. В настоящее время гликопептиды являются препаратами выбора при инфекциях, вызванных метициллинрезистентными стафилококками, а также энтерококками, резистентными к ампициллину. В качестве средств эмпирической терапии гликопептиды применяются при катетерассоциированном сепсисе и у больных с фебрильной нейтропенией (на втором этапе терапии).
Гликопептиды обладают бактерицидным действием, однако в отношении энтерококков, некоторых стрептококков и коагулазонегативных стафилококков они действуют бактериостатически. Гликопептиды обладают активностью в отношении грамположительных аэробных и анаэробных микроорганизмов: стафилококков (включая метициллинрезистентные штаммы), стрептококков, пневмококков (включая штаммы, резистентные к пенициллину), энтерококков, пептострептококков, листерий, коринебактерий, клостридий (включая С.difficile ). В отношении грамотрицательных микроорганизмов гликопептиды не активны, так как не проникают через их клеточную стенку. Спектр антимикробной активности ванкомицина и тейкопланина сходен, однако имеются некоторые различия в уровне природной активности и приобретенной резистентности. Тейкопланин проявляет in vitro более высокую активность в отношении золотистого стафилококка (в том числе штаммов, резистентных к метициллину), различных видов стрептококков (включая S.pneumoniae ) и энтерококков. Ванкомицин in vitro более активен в отношении коагулазонегативных стафилококков. В отношении анаэробных кокков и клостридий активность препаратов одинаковая.
Приобретенная резистентность к гликопептидам у грамположительных бактерий развивается редко. Несмотря на 40-летнее применение, не отмечено появления штаммов стафилококков, устойчивых к ванкомицину. В то же время в процессе применения тейкопланина может отмечаться снижение чувствительности к нему стафилококка и даже развитие резистентности. Период полувыведения ванкомицина составляет 6-8 ч, тейкопланина — от 40 до 120 ч в зависимости от метода его определения. Большой период полувыведения объясняет возможность назначения тейкопланина однократно в сутки. Ванкомицин и тейкопланин выводятся почками путем гломерулярной фильтрации, поэтому у больных с почечной недостаточностью требуется коррекция их режима дозирования. Препараты не удаляются при гемодиализе. Диапазон терапевтических концентраций гликопептидов в крови:
— ванкомицин: максимальные (через 0,5 ч) — 20-50 мг/л, минимальные (перед очередным введением) — 5-10 мг/л;
— тейкопланин: максимальные — 20-40 мг/л, минимальные — 5-15 мг/л.
Побочные эффекты гликопептидов. Нефротоксичность: обратимое нарушение функции почек (увеличение креатинина и мочевины в крови, анурия) наблюдается при применении ванкомицина в 5 % случаев и более; частота зависит от дозы и длительности применения препарата, возраста больных; риск увеличивается при сочетанном применении с аминогликозидами или петлевыми диуретиками и при превышении концентрации ванкомицина в крови свыше 10 мг/л. При применении тейкопланина нарушение функции почек отмечается реже. Ототоксичность: снижение слуха, вестибулярные нарушения (у больных с повышенной функцией почек). Нейротоксичность: головокружение, головная боль.
Реакции при внутривенном введении: покраснение лица и верхней части туловища, кожный зуд, боль за грудиной и тахикардия, иногда — гипотензия в результате высвобождения гистамина из тучных клеток, наблюдающееся при быстром внутривенном введении ванкомицина. На фоне применения тейкопланина эти реакции практически не наблюдаются.
Возможны также другие нежелательные реакции: флебиты, боль, жжение в месте введения, обратимая лейкопения, тромбоцитопения, транзиторное повышение трансаминаз, щелочной фосфатазы. Наиболее хорошо изученным и широко применяемым является ванкомицин. Ванкомицин применяется в следующих случаях:
— сокументированная инфекция различной локализации, вызванная метициллинрезистентными стафилококками (пневмония, инфекция кожи и мягких тканей, мочевыводящих путей, костей и суставов, перитонит, инфекционный эндокардит, сепсис);
— стафилококковые инфекции различной локализации при аллергии к пенициллинам и цефалоспоринам;
— тяжелые инфекции, вызванные чувствительными штаммами Enterococcus faecium, Enterococcus faecalis, Corynebacterium jejkeium ;
— инфекционный эндокардит, вызванный Streptococcus viridans и S.bovis (при аллергии к бета-лактамным антибиотикам), E.faecalis (в комбинации с гентамицином);
— менингит, вызванный пенициллинрезистентными штаммами S.pneumoniae .
В качестве средства эмпирической терапии жизнеопасных инфекций при подозрении на стафилококковую этиологию:
— инфекционный эндокардит трикуспидального или протезированного клапана (в сочетании с гентамицином);
— катетерассоциированный сепсис;
— посттравматический или послеоперационный менингит (в сочетании с цефалоспоринами III поколения или фторхинолонами);
— перитонит при перитонеальном диализе;
— фебрильная нейтропения (при неэффективности стартовой терапии).
Ванкомицин назначается также внутрь при антибиотикассоциированной диарее, вызванной Clostridium difficile . Ванкомицин назначается только внутривенно в виде медленной инфузии в течение 60-120 мин. У взрослых ванкомицин назначают по 1 г с интервалом 12 ч. У больных с нарушенной функцией почек дозу ванкомицина корректируют с учетом клиренса креатинина. При терминальной почечной недостаточности препарат вводят в дозе 1 г с интервалом 7-10 дней. При лечении псевдомембранозного колита, вызванного C.difficile , ванкомицин назначают внутрь в дозе 0,125 г каждые 6 ч (для приготовления раствора препарата порошок разводят в 30 мл воды; возможно использование сиропов или других добавок для улучшения вкусовых качеств).
Оксазолидиноны
Линезолид — первый представитель нового класса синтетических антимикробных средств — оксазолидинонов. Механизм действия линезолида связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других антибиотиков, ингибирующих синтез белка, линезолид воздействует на ранних этапах трансляции (необратимое связывание с 30S- и 50S-субъединицей рибосом), в результате чего нарушается процесс образования 70S-комплекса и формирование пептидной цепи. Благодаря уникальному механизму действия не отмечается перекрестной устойчивости микроорганизмов к линезолиду и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, АГ, тетрациклины и хлорамфеникол).
Принципиальным моментом в назначении линезолида является наличие в отделении МКSА-штаммов стафилококков, резистентность к гликопептидам (ванкомицину), наличие ванкомицинрезистентных штаммов энтерококков. Линезолид применяется при тяжелых нозокомиальных и вентиляторассоциированных пневмониях.
Постантибиотический эффект линезолида in vitro (ПАБЭ) для Staphylococcus aureus составляет примерно 2 часа. На экспериментальных моделях у животных ПАБЭ in vivo составлял 3,6-3,9 часа для Staphylococcus aureus и Streptococcus рпеиmоniае соответственно.
К линезолиду чувствительны микроорганизмы:
— грампозитивные аэробы: Corynebacterium jejkeium, Enterococcus faecalis (включая гликопептидрезистентные штаммы), Enterococcus faecium (гликопептидрезистентные штаммы), Enterococcus casseliflavus, Enterococcus gallinarum, Listeria monocytogenes, Staphylococcus aureus (включая МКSА-штаммы), Staphylococcus epidermidis, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus intermedius, Streptococcus рпеитоniае (включая штаммы с перекрестной чувствительностью к пенициллину и пенициллинрезистентные штаммы); Streptococcus pyogenes, стрептококки группы Viridans, стрептококки группы С;
— грамнегативные аэробы : Pasteurella canis, Pasteurella multocida;
— грампозитивные анаэробы : Clostridium perfingens, Peptostreptococcus anaerobius, Peptostreptococcus sрр.;
— грамнегативные анаэробы : Bacteroidas fragilis, Prevotella sрр.;
— другие : Chlamydia рпеито ni ае .
Умеренно чувствительные микроорганизмы:
— Legionella sрр ., Мо raxella са tarrhalis, Mycoplasma sрр .
Резистентные микроорганизмы :
— Neisseria sрр ., Pseudomonas sрр .
Практически важно, что линезолид сохраняет активность против метициллинрезистентных стафилококков, причем выраженность активности (по значениям МПК) не различается в отношении чувствительных и резистентных к метициллину штаммов. Линезолид проявляет выраженный эффект в отношении S.рпеитоniае , причем как штаммов чувствительных, так и устойчивых к пенициллину или эритромицину. В настоящее время не выделены штаммы S.рпеитоniае со сниженной чувствительностью к линезолиду. Линезолид также проявляет активность в отношении штаммов пневмококка, устойчивых к цефтриаксону, клиндамицину, тетрациклину, хлорамфениколу. Линезолид проявляет стабильную активность в отношении E.faecalis, E.faecium . Очень важное свойство линезолида — это сохранение активности в отношении тех штаммов энтерококков, которые резистентны к ванкомицину и тейкопланину, причем препарат проявляет действие при различных фенотипах устойчивости к гликопептидам. Линезолид проявляет сходную с ванкомицином активность в отношении грамположительных анаэробов — Clostridium perfingens , C.difficile и пептострептококков. В отличие от ванкомицина линезолид также действует на грамотрицательные анаэробные бактерии, в частности Bacteroidas fragilis , Fusobacterim sрр., Prevotella sрр.
Линезолид применяется в виде внутривенной инфузии и в лекарственной форме для приема внутрь. Линезолид быстро и полностью всасывается при приеме внутрь, максимальные концентрации в крови достигаются через 1-2 ч и составляют в среднем около 12 мкг/мл. Абсо лютная биодоступность препарата 100 %. Объем распределения линезолида составляет 50 л, связь с белками плазмы — 31 %, период полувыведения — 4,5-5,5 ч. Линезолид хорошо проникает в кожу и мягкие ткани, легкие, сердце, кишечник, печень, почки и ЦНС и умеренно — в синовиальную жидкость, кости, желчь. В большинстве органов концентрации линезолида составляют 60-70 % от величины сывороточных концентраций.
Линезолид метаболизирует в печени путем окисления с образованием двух метаболитов, обладающих очень слабой антибактериальной активностью. Линезолид применяется для лечения инфекций различной локализации у взрослых и детей, вызванных грамположительными микроорганизмами (стафилококками, пневмококками, энтерококками):
— тяжелая внебольничная или госпитальная пневмония;
— осложненные инфекции кожи и мягких тканей;
— неосложненные инфекции кожи и мягких тканей в амбулаторной практике;
— осложненные инфекции мочевыводящих путей;
— бактериемия или сепсис;
— интраабдоминальные инфекции;
— инфекционный эндокардит.



Линезолид оказывает слабое действие на грамотрицательные бактерии , поэтому при выделении последних следует к лечению присоединить цефалоспорин III-IV поколения или фторхинолон. В эмпирической терапии линезолид может рассматриваться как средство выбора при тяжелых инфекциях — остеомиелите, эндокардите или протезировании клапана, катетерассоциированной бактериемии или сепсисе, перитоните у больных на постоянном амбулаторном перитонеальном диализе. У больных с нейтропенической лихорадкой линезолид может назначаться на втором этапе лечения при неэффективности стартовой терапии. В стационарах с высокой частотой МRSА линезолид может рассматриваться в качестве средства эмпирической терапии тяжелых больных (ОРИТ, пневмония на ИВЛ, гемодиализ, ожоговая травма). Особыми показаниями для назначения линезолида в качестве средства этиотропной терапии являются:
— инфекции любой локализации, вызванные МRSА;
— инфекции, вызванные энтерококками, устойчивыми к ампициллину;
— инфекции, вызванные E.faecium , устойчивым к ванкомицину;
— тяжелые инфекции, вызванные S.рпеитоniае , устойчивым к пенициллину и цефалоспоринам III поколения, прежде всего менингит и сепсис.
Побочные эффекты. Боль, спазмы в животе, вздутие, отклонение гематологических показателей и показателей функции печени, диарея, головная боль, кандидомикоз, тошнота, рвота, тромбоцитопения, лейкопения и панцитопения. Нейропатия (периферическая глазного нерва) наблюдается при использовании линезолида при превышении максимально рекомендованой длительности лечения в 28 дней.
При гемодиализе выводится приблизительно 30 % дозы линезолида.
Особенности использования. У некоторых пациентов может развиться миелосупрессия (анемия, тромбоцитопения, лейкопения и панцитопения), что полностью зависит от длительности терапии. Линезолид назначается 2 раза в день внутривенно или перорально. При приеме внутрь хорошо всасывается из ЖКТ, максимум концентрации в крови через 2 ч. Раствор для инфузий следует вводить на протяжении 30-120 мин.
Пациентов, которые начали лечение с пероральной формы, по клиническим показаниям можно переводить на прием лекарственной формы препарата для инъекций, и наоборот. В таком случае дополнительный подбор дозы не нужен, так как биодоступность линезолида как при приеме внутрь, так и внутривенно составляет почти 100 %.
Использование при беременности и лактации. Адекватных исследований безопасности применения линезолида при беременности не проводилось, поэтому препарат следует использовать у данной категории пациентов только по абсолютным жизненным показаниям. Неизвестно, проникает ли линезолид в грудное молоко, поэтому его следует применять с осторожностью.
Фармакокинетика в разных группах больных. Клиренс линезолида выше у детей и снижается с возрастом. Фармакокинетика линезолида существенно не изменяется у группы пациентов старше 65 лет. Отмечены некоторые фармакокинетические отличия у женщин, которые выражаются в несколько меньшем объеме распределения, снижении клиренса приблизительно на 20 %, иногда в более высоких концентрациях в плазме. Для пациентов с умеренной, средней и тяжелой почечной недостаточностью коррекции дозы не нужно, поскольку нет зависимости между клиренсом креатинина и выведением препарата через почки. Поскольку 30 % дозы препарата выводится на протяжении 3 часов гемодиализа, пациентам, которые получают подобное лечение, линезолид необходимо назначать после диализа. Фармакокинетика линезолида не изменяется у пациентов с печеночной недостаточностью, в связи с этим нет необходимости корректировать дозу препарата. Фармакокинетика линезолида у пациентов с тяжелой печеночной недостаточностью не изучена. Однако поскольку линезолид метаболизируется вследствие неферментативного процесса, то очевидно, что функция печени существенно не изменяет метаболизм линезолида.
Взаимодействие с другими лекарственными препаратами.
Фармакологическое. Линезолид — раствор для инфузий совместим с такими растворами: 5% раствор декстрозы, 0,9% раствор хлорида натрия, раствор Рингералактат для инъекций. Не следует вводить дополнительные компоненты в раствор линезолида для инфузий. Линезолид в растворе для инфузий физико-химически несовместим с такими препаратами: амфотерицин В, хлорпромазина гидрохлорид, диазепам, пентамидина изетионат, фенитоин натрия, эритромицина лактобионат и триметоприм-сульфаметоксазол. Кроме того, раствор химически не может быть совместим с цефтриаксоном.
Фармакодинамическое. Линезолид является слабым обратным неселективным ингибитором моноаминоксидазы (МАО), поэтому у некоторых пациентов препарат может причинять умеренное усиление прессорного действия псевдоэфедрина гидрохлорида и фенилпропаноламина гидрохлорида. Рекомендуется уменьшить начальные дозы адренэргических препаратов, таких как допамин (или его агонистов), и в дальнейшем производить титрование дозы.
Фармакокинетическое. Фармакокинетика линезолида не изменяется при одновременном использовании азтреонама и гентамицина.
Бактерицидные макролиды
Макролиды-азолиды — азитромицин (наименее токсичный антибиотик, активность в отношении грамположительных кокков и внутриклеточных возбудителей — хламидии, микоплазмы, кампилобактерии, легионеллы).
Макролиды-кетолиды — эритромицин-ацистрат (высокая активность против энтерококков, в том числе нозокомиальных, ванкомицинрезистентных штаммов, микобактерий, бактероидов).
Бактериостатические макролиды (препараты широкого спектра, имеют длительный период полувыведения, можно вводить 1-2 раза в сутки, широкое применение в лечении токсоплазмоза и профилактике менингита, активность в отношении хламидий и легионелл).
1-е поколение — эритромицин, олеандомицин.
2-е поколение — спиромицин, рокситромицин, мидекамицин, джозамицин, диритромицин, кларитромицин, китазамицин.
Общие свойства макролидов:
1. Преимущественно бактериостатическое действие.
2. Активность против грамположительных кокков (стрептококки, стафилококки) и внутриклеточных возбудителей (микоплазмы, хламидии, легионеллы).
3. Высокие концентрации в тканях (в 5-10-100 раз выше плазменных).
4. Низкая токсичность.
5. Отсутствие перекрестной аллергии с β-лактамами.
Среди макролидов особого внимания заслуживает кларитромицин (клацид) как единственный из новых макролидов, имеющий внутривенную форму введения. Данное обстоятельство позволяет использовать его при лечении неосложненной внегоспитальной пневмонии или как препарат 2-го ряда при терапии госпитальной пневмонии. Однако, по последним сообщениям, детального рассмотрения заслуживает проблема устойчивости S.рпеитоniае к макролидным антибиотикам. Устойчивость пневмококков к макролидам (так же, как и пиогенных стрептококков) может быть обусловлена либо ферментативной модификацией мишени действия (метилированием рибосомальной РНК), либо активным выведением препаратов из микробной клетки. При первом механизме наблюдают полную перекрестную устойчивость между всеми макролидами, при втором пневмококки проявляют устойчивость к 14- и 15-членным макролидам при чувствительности к 16-членным. Между всеми включенными в Аlexander Project макролидами наблюдали полную перекрестную резистентность. Вторым практически важным фактом является наличие ассоциации между устойчивостью к пенициллину и макролидам. Это наблюдение находит полное подтверждение во всех исследованиях, посвященных антибиотикорезистентности пневмококков. Тревожным фактом является также стабильный рост устойчивости к макролидам (в некоторых европейских странах устойчивость к макролидам выше, чем к пенициллину). Причем нарастание устойчивости коррелирует с увеличением потребления современных макролидов с пролонгированной фармакокинетикой (азитромицина и кларитромицина). Для макролидов традиционные и фармакодинамически обоснованные критерии чувствительности совпадают. Следовательно, есть все основания предполагать наличие у этих антибиотиков высокой бактериологической эффективности при пневмококковых инфекциях, вызванных чувствительными штаммами. Имеющиеся клинические данные находятся в полном соответствии с этим предположением. В то же время нерешенным является вопрос о клинической эффективности 14- и 15-членных макролидов при инфекциях, вызываемых пневмококками с устойчивостью, обусловленной активным выведением. Ряд наблюдений свидетельствует о том, что при пневмониях, вызываемых такими микроорганизмами, клиническая эффективность 14- и 15-членных макролидов сохраняется. Обсуждаются предложения о пересмотре критериев чувствительности пневмококков к макролидам (увеличение значения пограничной МПК эритромицина от 1 до 8 или 16 мкг/мл). Таким образом, как для β-лактамов, так и для макролидов микробиологическая устойчивость далеко не всегда означает неудачу лечения.
Развитие большинства заболеваний связано с инфицированием различными микробами. Существующие для борьбы с ними противомикробные препараты представлены не только антибиотиками, но и средствами, обладающими более узким спектром воздействия. Рассмотрим подробнее данную категорию лекарств и особенности их применения.
Противомикробные средства - что это?
- Антибактериальные средства - самая большая группа препаратов для системного применения. Получают их с помощью синтетических или полусинтетических методов. Могут нарушать процессы размножения бактерий или же уничтожать патогенные микроорганизмы.
- Антисептики обладают широким спектром действия и могут использоваться при поражении различными патогенными микробами. Применяются в основном для местной обработки поврежденных кожных покровов и слизистых поверхностей.
- Антимикотики - препараты противомикробного действия, подавляющие жизнеспособность грибов. Могут применяться как системно, так и наружно.
- Противовирусные препараты способны влиять на размножение различных вирусов и вызывать их гибель. Представлены в виде системных медикаментов.
- Противотуберкулезные средства препятствуют жизнедеятельности палочки Коха.
В зависимости от вида и тяжести заболевания одновременно могут быть назначены несколько типов антимикробных лекарств.
Виды антибиотиков
Побороть недуг, вызванный патогенными бактериями, можно только с помощью антибактериальных средств. Они могут иметь природное, полусинтетическое и синтетическое происхождение. В последнее время все чаще применяются препараты, относящиеся к последней категории. По механизму действия различают бактериостатические (вызывают гибель болезнетворного агента) и бактерицидные (препятствуют жизнедеятельности бацилл) средства.

Антибактериальные противомикробные препараты подразделяют на следующие основные группы:
- Пенициллины натурального и синтетического происхождения - первые обнаруженные человеком лекарства, способные бороться с опасными инфекционными заболеваниями.
- Цефалоспорины имеют схожее с пенициллинами воздействие, но при этом гораздо реже вызывают аллергические реакции.
- Макролиды подавляют рост и размножение патогенных микроорганизмов, оказывая наименьшее токсическое влияние на организм в целом.
- Аминогликозиды применяются для уничтожения грамотрицательных анаэробных бактерий и считаются наиболее токсичными антибактериальными препаратами;
- Тетрациклины могут быть природными и полусинтетическими. Применяются в основном для местного лечения в виде мазей.
- Фторхинолоны - лекарства с мощным бактерицидным эффектом. Применяются в процессе лечения ЛОР-патологий, заболеваний органов дыхания.
- Сульфаниламиды - противомикробные препараты широкого действия, чувствительность к которым проявляют грамотрицательные и грамположительные бактерии.
Эффективные антибиотики
Назначать для лечения того или иного недуга препараты с антибактериальным воздействием следует только в том случае, когда подтверждено инфицирование бактериальным возбудителем. Лабораторная диагностика также поможет определить вид болезнетворного микроорганизма. Это необходимо для правильного подбора медикамента.
Чаще всего специалисты назначают антибактериальные (противомикробные) препараты широкого спектра воздействия. К таким медикаментам чувствительность проявляют большинство патогенных бактерий.
К эффективным антибиотикам можно отнести такие препараты, как «Аугментин», «Амоксициллин», «Азитромицин», «Флемоксин Солютаб», «Цефодокс», «Амосин».
«Амоксициллин»: инструкция по применению
Медикамент относится к категории полусинтетических пенициллинов и применяется при лечении воспалительных процессов различной этиологии. «Амоксициллин» выпускают в форме таблеток, суспензии, капсул и раствора для инъекций. Применять антибиотик необходимо при патологиях органов дыхательного тракта (нижнего и верхнего отдела), заболеваниях мочеполовой системы, дерматозах, сальмонеллезе и дизентерии, холецистите.
В виде суспензии лекарство может применяться для лечения детей с самого рождения. Дозировку в этом случае рассчитывает только специалист. Взрослым, согласно инструкции, необходимо принимать по 500 мг амоксициллина тригидрата 3 раза в день.
Особенности применения
Применение противомикробных препаратов часто вызывает развитие аллергических реакций. Это следует учитывать еще до начала терапии. Многие врачи рекомендуют одновременно с антибиотиками принимать антигистаминные препараты, чтобы исключить появление побочных явлений в виде сыпи и покраснения кожных покровов. Запрещается принимать антибиотики при непереносимости любого из компонентов лекарства или наличии противопоказаний.
Представители антисептиков
Инфекция часто попадает в организм через поврежденные кожные покровы. Чтобы избежать этого, следует незамедлительно обрабатывать ссадины, порезы и царапины специальными антисептическими средствами. Такие противомикробные препараты действуют и на бактерии, и на грибки, и на вирусы. Даже при длительном применении патогенные микроорганизмы практически не вырабатывают резистентность к действующим компонентам этих лекарств.

К наиболее популярным антисептикам относятся такие медикаменты, как раствор йода, борная и салициловая кислота, этиловый спирт, перманганат калия, перекись водорода, нитрат серебра, «Хлоргексидин», «Колларгол», раствор Люголя.
Антисептические препараты часто применяются для лечения заболеваний горла и полости рта. Они способны подавить размножение болезнетворных агентов и купировать воспалительный процесс. Приобрести их можно в форме спреев, таблеток, леденцов, пастилок и растворов. В качестве дополнительных компонентов в составе таких препаратов часто используются эфирные масла, витамин C. К наиболее действенным антисептикам для лечения горла и ротовой полости относятся следующие:
- «Ингалипт» (спрей).
- «Септолете» (пастилки).
- «Мирамистин» (спрей).
- «Хлорофиллипт» (раствор для полоскания).
- «Гексорал» (спрей).
- «Нео-ангин» (леденцы).
- «Стоматидин» (раствор).
- «Фарингосепт» (таблетки).
- «Лизобакт» (таблетки).
Когда применять «Фарингосепт»?
Мощным и безопасным антисептиком считается препарат «Фарингосепт». При наличии у пациента воспалительного процесса в горле многие специалисты назначают именно эти противомикробные таблетки.

Препараты, содержащие моногидрат амбазона (как и «Фарингосепт»), обладают высокой эффективностью при борьбе со стафилококками, стрептококками и пневмококками. Действующее вещество препятствует процессам размножения болезнетворных агентов.
Антисептические таблетки рекомендуют при стоматитах, фарингитах, ангинах, гингивитах, трахеитах, тонзиллитах. В составе комплексной терапии «Фарингосепт» часто используется в процессе лечения синуситов и ринитов. Назначать лекарство можно пациентам старше трех лет.
Препараты для лечения грибка
Какие противомикробные препараты необходимо использовать при лечении грибковых инфекций? Справиться с такими недугами под силу только антимикотическим средствам. Обычно для лечения применяются противогрибковые мази, кремы и растворы. В тяжелых случаях врачи назначают системные препараты.

Антимикотики могут оказывать фунгистатическое или фунгицидное воздействие. Это позволяет создать условия для гибели спор грибка или предотвращать процессы размножения. Эффективные противомикробные препараты с антимикотическим эффектом назначаются исключительно специалистом. Лучшими являются следующие медикаменты:
- «Флуконазол».
- «Клотримазол».
- «Нистатин».
- «Дифлюкан».
- «Тербинафин».
- «Ламизил».
- «Тербизил».
В тяжелых случаях показано применение одновременно местных и системных антимикотических медикаментов.
Антибиотики - это вещества органического происхождения, которые вырабатываются некоторыми микроорганизмами, растениями, или животными с целью защиты от воздействия различных бактерий; замедляют их рост и темп развития, или убивают.
Первый антибиотик, пенициллин, был случайно синтезирован из микроскопического гриба шотландским ученым Александром Флемингом еще в далеком 1928 году. Через 12 лет после изучения свойств пенициллина, Великобритания начала выпуск лекарства в промышленных масштабах, а годом позже пенициллин начали вырабатывать в США.
Благодаря этому случайному открытию шотландского ученого мировая медицина получила уникальную возможность эффективно бороться с заболеваниями, которые раньше считались смертельно опасными: воспаление легких, туберкулез, гангрена и прочие.
В современном мире известно уже около 300 000 этих противомикробных препаратов. Их сфера применения действительно широка - кроме медицины, они успешно используются в ветеринарии, животноводстве(таблетки антибиотика стимулируют быстрый набор животным веса и роста) и в качестве инсектицидов для нужд сельского хозяйства.
Антибиотики производятся из:
- материалов плесневых грибов;
- из бактерий;
- из актомицетов;
- из растительных фитонцидов;
- из тканей некоторых видов рыб и животных.
Основные характеристики препаратов
В зависимости от сферы применения:
- Противомикробные.
- Противоопухолевые.
- Антигрибковые.
В зависимости от природы происхождения:
- препараты естественного происхождения;
- препараты синтетического характера;
- препараты полусинтетического характера(на начальной стадии процесса часть сырья получается из природных материалов, а остальное синтезируют искусственным методом).
По сути, антибиотиками являются только природные ингибиторы, а искусственные - это уже специальные "антибактериальные препараты".
В зависимости от вида возбудителя относительно клетки, антибиотики делятся на два типа:
- бактерицидные , которые нарушают целостность микробной клетки, вследствие чего она полностью, или частично, теряет свои жизнеспособные свойства, либо погибает;
- бактеростатические , которые только блокируют развитие клетки, данный процесс является обратимым.
По химическому составу:

Величина силы действия антибиотиков измеряется в так называемых ЕД - единицах действия, содержащихся в 1 миллилитре раствора, или 0,1 грамме химически чистого синтезированного вещества.
По ширине спектра антимикробного действия:
- антибиотики широкого спектра действия, которые успешно применяются для лечения заболеваний разного инфекционного характера;
- антибиотики узкого спектра действия - считаются более безопасными и безвредными для организма, так как действуют на определенную группу возбудителей и не подавляют всю микрофлору человеческого организма.
 Одна из основных причин уникальности антибиотиков, как вещества - возможность их широчайшего применения для лечения самых разнообразных заболеваний.
Одна из основных причин уникальности антибиотиков, как вещества - возможность их широчайшего применения для лечения самых разнообразных заболеваний.
Мнения по поводу антибиотиков широкого действия кардинально разделяются. Одни утверждают, что эти таблетки и средства - это настоящая бомба замедленного действия для организма, убивающая все живое на своем пути, а вторые считают их панацеей от всех болезней и активно используют при любом малейшем недомогании.
Основные типы антибиотиков широкого спектра действия
| Тип антибиотика | Механизм действия, особенности | Что лечит | В каких препаратах содержится |
Пенициллины
|
Подавляют пептидогликаны - основные компоненты стенки бактериальной клеточки, в результате чего она погибает. | Гнойное заражение крови, заболевание лимфатических путей, менингит, фурункулы, воспаления органов брюшной и грудной полости. | Пенициллин |
Цефалоспорины(4 поколения)
|
Очень устойчивы к β-лактамазым ферментам, которые вырабатываются микроорганизмами, содержат разрушающие их вещества. | Гонорея, различные ЛОР-инфекции, пиелонефрит. | Цефалексин, Цефадроксил, Цефаклор, Цефуроксим |
| Макролиды | Наименее токсичны и аллергенны; "умные" антибиотики, вещества которых централизуются именно в очаге заболевания. С каждым поколением расширяется спектр действия и понижается токсичность. | Воспаление лимфоузлов, пазух и придатков носа, среднего уха, миндалин, легких и бронхов, инфекции области малого таза. | Эритромицин, Кларитомицин,Мидекамицин, Мидекамицина ацетат |
| Тетрациклины | Имеют бактеристатические свойства и являются перекрестно восприимчивыми. | Сифилис, микроплазмоз, гонорея. | Моноклин, Рондомицин,Тетрациклин. |
Аминогликозиды(3 поколения)
|
Содержат молекулу аминосахара в своем кольце; бактерицидные свойства ярко выражены; самостоятельно уничтожает вражеские клетки без участи организма-хозяина. | Болезни и общая слабость иммунной системы, воспаления мочеполовых путей, фурункулы, воспаление внешнего уха, острые болезни почек, тяжелые формы пневмонии, сепсис. | Неомицин, Стретомицин, |
Фторхинолоны(4 поколения)
|
Действующие вещества антибиотика проникают в клетку бактерии и убивают её. | Синусит, фарингит, воспаление лёгких, мочеполовая система. | Ломефлоксацин, Норфлоксацин, Офлоксацин, Пефлоксацин, Ципрофлоксацин, Левофлоксацин, Спарфлоксацин |
Наука и медицина не стоит на месте, поэтому существует уже около 6 поколений цефалоспориновых, аминогликозидных и фторхиноловых антибиотиков. Чем старше поколение антибиотика, тем более он является современным и действенным, а также малотоксичным по отношению к организму хозяина.
Препараты VI поколения действия
Очень эффективными являются антибиотики 4 поколения, благодаря особенностям своей химической структуры они способны проникать прямо в цитоплазматическую мембрану и воздействовать на инородную клетку изнутри, а не снаружи.
Цефаллоспорины
 Цефаллоспорины, предназначенные для приема внутрь, не воздействуют на ЖКТ негативным образом, прекрасно всасываются и распределяются с током крови. Распределяются по всем органам и тканям, исключая предстательную железу. Выводятся с мочой из организма через 1-2 часа после завершения действия. Противопоказание - наличие аллергической реакции на цефаллоспорины.
Цефаллоспорины, предназначенные для приема внутрь, не воздействуют на ЖКТ негативным образом, прекрасно всасываются и распределяются с током крови. Распределяются по всем органам и тканям, исключая предстательную железу. Выводятся с мочой из организма через 1-2 часа после завершения действия. Противопоказание - наличие аллергической реакции на цефаллоспорины.
Применяются для лечения всех форм тяжести пневмонии, инфекционных поражений мягких тканей, дерматологических недугов бактериального очага действия, инфекции костной ткани, суставов, сепсиса и пр.
Цефаллоспорины следует принимать внутрь во время принятия пищи, запивая их большим количеством пищевой воды. Жидкие формы лекарств принимаются вовнутрь согласно составленной инструкции и рекомендациям лечащего врача.
Следует строго и неуклонно соблюдать курс лечения, проводить приемы противомикробных препаратов в точно назначенное время и не пропускать их приемов. Во время этого следует полностью отказаться от употребления спиртных напитков, иначе лечение не даст должного эффекта.
К группе цефаллоспоринов 4 поколения относятся такие препараты, как цефипим, цефкалор, цефхином, цефлуретан и другие.Эти антибиотики в аптеках представлены в очень широком ассортименте производителей разных стран и являются относительно дешевыми - ценовой диапазон от 3 до 37 грн. Выпускаются в основном в форме таблеток.
Фторхинолоны
В классе фторхинолонов 4 поколения имеется только один представитель - антибиотик моксифлоксацин.Он превосходит всех своих предшественников по уровню активности против возбудителей-пневмококков и разных нетипичных патогенов, таких как микроплазмы и хламидии.
В результате приема внутрь наблюдается высокий показатель всасываемости и усвоения - более, чем 90% действующего вещества. Широко применяется при таких заболеваниях, как острый синусит(в том числе и запущенная форма), бактериальные заболевания лёгких и дыхательных путей(воспаление, обострение хронического бронхита и пр.), а также как бактерицидное средство при различных кожных инфекциях и заболеваниях.
Не предназначен для лечения детей. Выпускается в виде таблеток под названием "Авелокс" и стоит достаточно много - около 500 грн.
Правила применения антибиотиков
Эти препараты способны принести организму как огромную пользу, так и причинить огромный вред. Во избежание последнего следует придерживаться строгих правил приема лекарств:
Случаи, в которых таблетки антибиотика не действуют:
- Очаги инфекции вирусного характера. В таких случаях антибиотики не только не смогут помочь, но и способны усугубить состояние болезни. Особенно это касается ОРВИ;
- Антибиотики борются с причинами-возбудителями болезни, а не с их последствиями, поэтому боль в горле, заложенность носа и повышенную температуру излечить они никак не смогут;
- Вне зоны их специализации также находятся воспалительные процессы не бактериального характера.
Что нельзя делать при помощи антибиотиков:
- Излечить абсолютно все болезни;
- Излечить вирусные инфекции и их последствия;
- Нельзя слишком часто принимать таблетки, особенно при их пероральном применении;
- Употреблять алкогольные напитки;
- Скрывать от врача причины появления и все нюансы болезни;
- Затягивать с началом приема, так как большинство антибиотиков хорошо действуют только в первые 2-4 дня с начала инфицирования.
Побочные эффекты, которые могут иногда возникать при приеме:
Поэтому не стоит игнорировать основные противопоказания приема антибиотиков:
- Беременность, почти во всех её случаях. Далеко не каждый врач решиться прописать женщине во время беременности антибиотики, так как считается, что механизм их действия в этом случае может быть непредсказуемым и спровоцировать негативные последствия как для ребенка, так и для самой матери;
- кормление грудью. На время лечения антибиотиками кормление грудью стоит приостановить, а через несколько дней после окончания приема таблеток начать снова;
- при наличии почечной и сердечной недостаточности, так как эти органы отвечают за циркуляцию и вывод вещества из организма;
- детям без предварительной консультации доктора. Чаще всего детям назначают специальные "мягкие" антибиотики, которые содержат в себе относительно небольшую концентрацию действующего вещества и не вызовут аллергии и дисбактериоза. А для удобства применения они выпускаются не в форме таблеток, а сладких сиропов.
Природные антибиотики

